دوره مهارت آموزی ژن درمانی
آزمایشگاه ژنیران برگزار کننده دوره کارآموزی ژن درمانی (کارگاه ژن درمانی) به صورت نیمه خصوصی میباشد.
دوره ی جامع ژن درمانی بر پایه تکنیک های In silico میباشد و در
۱۰ جلسه ۲ ساعته به همراه ۱۰ ساعت رفع اشکال (مجموعا ۳۰ ساعت) برگزار میشود.
کلاس های دوره ژن درمانی به صورت آنلاین و نیمهخصوصی (۶ تا ۱۲ نفره) برگزار میگردد.
با اعطای مدرک از آزمایشگاه ژنیران-انجمن بیوتکنولوژی کشور و ITE لندن
شروع دوره:
- ۲۲ اردیبهشت (آنلاین)
- ۲۰ تیر (آنلاین)
- ۲۶ شهریور (آنلاین)
- هزینه دوره: ۴ میلیون و ۵۰۰ هزار تومان
برای ثبت نام کافیست فقط 20 درصد هزینه کل را بپردازید. 80 درصد باقی مانده را می توانید در اقساط 3 ماهه با چک صیادی پرداخت کنید. اطلاعات بیشتر
سرفصل های دوره کارآموزی ژن درمانی:
۱. بررسی منشا اطلاعات ژنومیک و دادههای ژنومیک
-
- (NCBI و UCSC)
۲. روش های ژن درمانی و کاربرد آن ها در سرطان و بیماری ها
-
- ویرایش ژنی با CRISPR-Cas9، TALEN و ZFN
۳. پروتئینهای نوترکیب و کاربرد آنها در ژن درمانی
۴. اصول کلونینگ و کاربردهای آن از طراحی تا اجرا برای اهداف درمانی
-
- برش های آنزیمی، طراحی وکتور، ligation، Transformation و Mal transfection
۵. درک اصول ویرایش ژنی وبررسی یافتههای جدید این حوزه و نحوه کارکرد آن در درمان بیماریها
۶. تکنولوژی CRISPR-Cas9 در ویرایش ژنوم
-
- آماده سازی وکتور و قطعه مورد نظر
- طراحی کلونینگ و دلیوری sgRNA (نرم افزارهای آنلاین)
- آنالیزهای insilico
۷. تکنولوژی ZFN در ویرایش ژنومی
-
- طراحی سیستم و مزایا و مشکلات سیستم
- موارد تعیین شده در clinical trial
۸. تکنولوژی TALEN در ویرایش ژنومی
-
- طراحی سیستم و مزایا و مشکلات سیستم
- موارد تعیین شده در clinical trial
۹. ژن درمانی با ویروس ها
-
- طراحی وکتور
- Co-Transfection
- رترو ویروس ها
ژن درمانی چیست؟
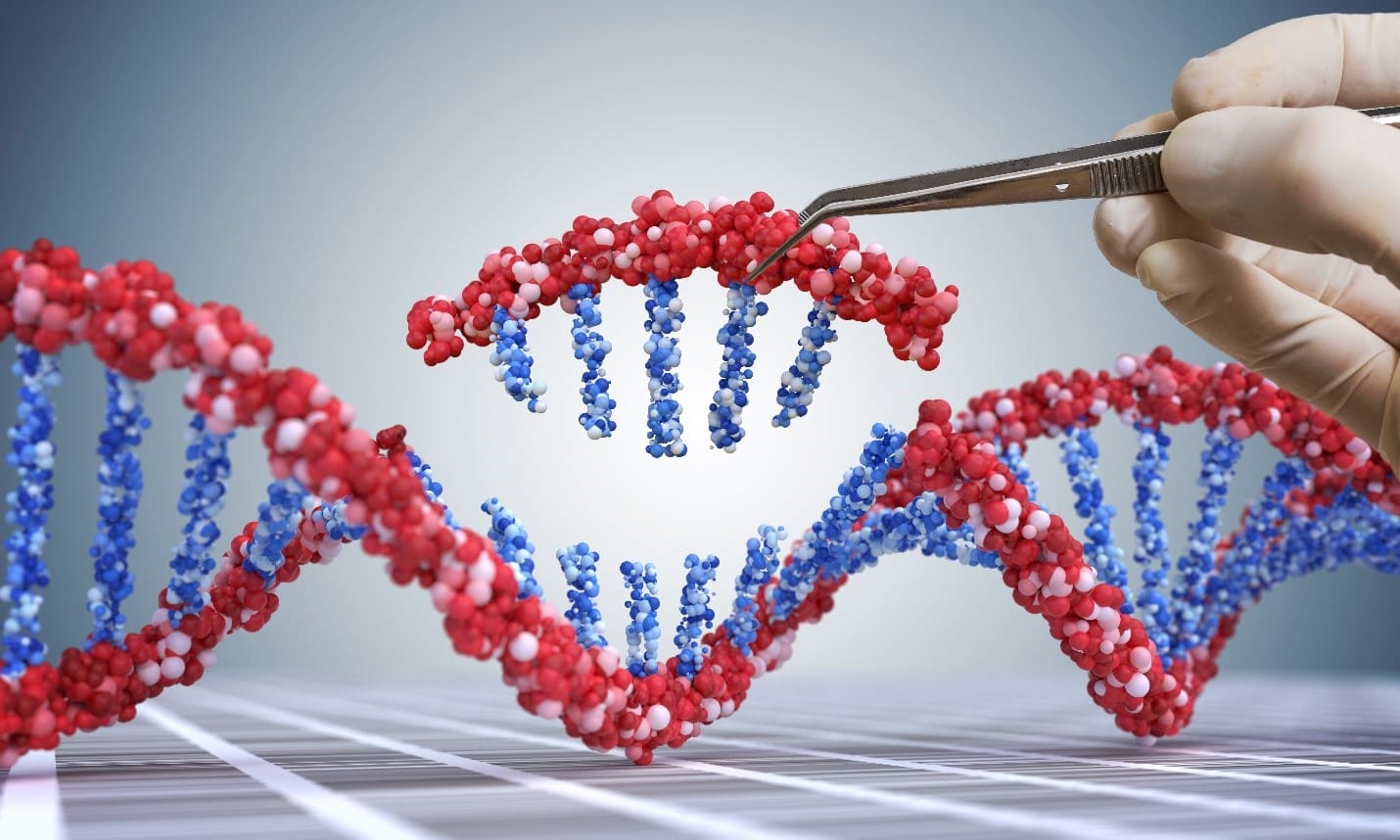
ژن درمانی یک رویکرد پزشکی است که با اصلاح مشکل ژنتیکی زمینه را برای درمان بیماری یا پیشگیری از بیماری فراهم می کند. تکنیک های ژن درمانی به پزشکان این امکان را می دهد که به جای استفاده از دارو یا جراحی، با تغییر ساختار ژنتیکی یک اختلال را درمان کنند.
اولین روش ژن درمانی، که اغلب انتقال ژن یا افزودن ژن نامیده می شود، برای موارد زیر توسعه یافته است:
- معرفی یک ژن جدید به سلول ها برای کمک به مبارزه با یک بیماری.
- معرفی یک کپی غیر معیوب از یک ژن برای جایگزینی نسخه تغییر یافته که باعث بیماری می شود.
مطالعات بعدی منجر به پیشرفت در تکنیک های ژن درمانی شد. یک تکنیک جدیدتر به نام ویرایش ژنوم (نمونه ای از آن CRISPR-Cas9) از رویکرد متفاوتی برای اصلاح تفاوت های ژنتیکی استفاده می کند. ویرایش ژنوم به جای معرفی مواد ژنتیکی جدید به سلول ها، ابزارهای مولکولی را برای تغییر DNA موجود در سلول معرفی می کند. ویرایش ژنوم در حال مطالعه است تا:
- بتواند یک تغییر ژنتیکی که زمینه ساز یک اختلال است را اصلاح کند تا ژن بتواند به درستی عمل کند.
- بتواند یک ژن را برای کمک به مبارزه با یک بیماری روشن کند.
- بتواند ژنی را که عملکرد نامناسبی دارد خاموش کند.
- بتواند قطعه ای از DNA را که عملکرد ژن را مختل کرده و باعث بیماری می شود را بردارد.
ژن درمانی برای درمان تعداد کمی از بیماری ها، از جمله یک اختلال چشمی مادرزادی به نام Leber congenital amaurosis یا (LCA) و یک اختلال عضلانی به نام آتروفی عضلانی نخاعی استفاده می شود. بسیاری از ژن درمانی های در حال انجام تحقیقاتی هستند تا مطمئن شوند که ایمن و موثر خواهند بود. ویرایش ژنوم یک تکنیک امیدوارکننده است که پزشکان امیدوارند به زودی از آن برای درمان اختلالات در افراد استفاده کنند.
ژن درمانی چگونه کار می کند؟
ژن درمانی با تغییر کد ژنتیکی برای بازیابی عملکرد پروتئین های حیاتی عمل می کند. پروتئین ها کارگرهای سلول و اساس ساختاری بافت های بدن هستند.
دستورالعملهای ساخت پروتئینها در کد ژنتیکی افراد وجود دارد و تغییرات یا جهشها در این کدها میتوانند بر تولید یا عملکرد پروتئینهایی که ممکن است برای نحوه عملکرد بدن حیاتی باشند، تأثیر بگذارند. اصلاح یا جبران تغییرات ژنتیکی بیماریزا ممکن است نقش این پروتئینهای مهم را بازیابی کند و به بدن اجازه دهد تا طبق انتظار عمل کند.
ژن درمانی می تواند تغییرات ژنتیکی را به روش های مختلف جبران کند.
انتقال ژن با رویکرد ژن درمانی، مواد ژنتیکی جدیدی را وارد سلول ها می کند. اگر یک ژن تغییر یافته باعث شود پروتئین لازم معیوب یا از بین رفته باشد، انتقال ژن با رویکرد ژن درمانی می تواند یک نسخه طبیعی از ژن را برای بازیابی عملکرد پروتئین معرفی کند. به عبارت دیگر، ژن درمانی میتواند ژن متفاوتی را معرفی کند که دستورالعملهایی را برای پروتئین ارائه میکند که به عملکرد طبیعی سلول، علیرغم تغییر ژنتیکی، کمک میکند.
ویرایش ژنوم یک تکنیک جدیدتر است که ممکن است به طور بالقوه برای ژن درمانی استفاده شود. ویرایش ژنوم به جای افزودن مواد ژنتیکی جدید، ابزارهای ویرایش ژن را معرفی می کند که می تواند DNA موجود در سلول را تغییر دهد. فن آوری های ویرایش ژنوم اجازه می دهد تا مواد ژنتیکی در مکان های دقیق ژنوم اضافه، حذف یا تغییر داده شود. CRISPR-Cas9 نوع شناخته شده ای از ویرایش ژنوم است.
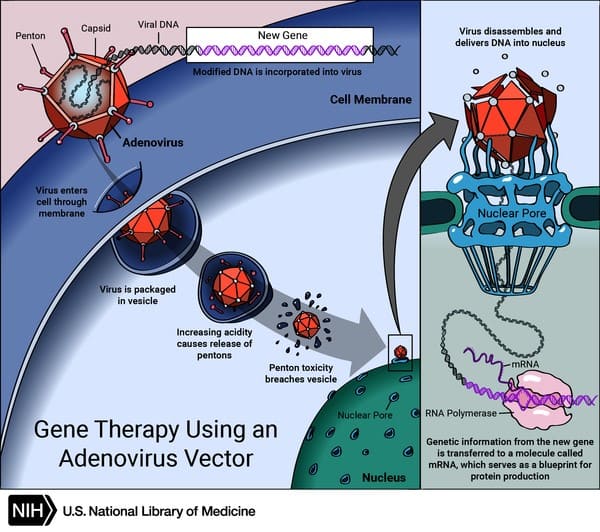
مواد ژنتیکی یا ابزارهای ویرایش ژن که مستقیما به سلول وارد می شوند معمولا کار نمی کنند. در عوض، حاملی به نام وکتور به طور ژنتیکی برای حمل و تحویل مواد ساخته شده است. برخی از ویروسها به عنوان ناقل استفاده میشوند، زیرا میتوانند با آلوده کردن سلول، مواد را تحویل دهند. این ویروسها اصلاح شدهاند تا در صورت استفاده در افراد باعث بیماری نشوند.
برخی از انواع ویروسها مانند رتروویروسها، مواد ژنتیکی خود (از جمله ژن جدید) را در یک کروموزوم در سلول انسانی ادغام میکنند. سایر ویروس ها مانند آدنوویروس ها DNA خود را به هسته سلول وارد می کنند، اما DNA در یک کروموزوم ادغام نمی شود. ویروس ها همچنین می توانند ابزارهای ویرایش ژن را به هسته سلول تحویل دهند.
این ناقل را می توان به صورت داخل وریدی یا از طریق (IV) مستقیما به بافت خاصی در بدن تزریق کرد، جایی که توسط سلول های جداگانه جذب می شود. متناوبا، می توان نمونه ای از سلول های بیمار را برداشت و در محیط آزمایشگاهی در معرض ناقل قرار داد. سپس سلول های حاوی ناقل به بیمار بازگردانده می شوند. اگر درمان موفقیت آمیز باشد، ژن جدیدی که توسط ناقل تحویل داده می شود، یک پروتئین فعال می سازد یا مولکول های ویرایش کننده خطای DNA را تصحیح کرده و عملکرد پروتئین را بازیابی می کنند.
ژن درمانی با ناقل های ویروسی موفقیت آمیز بوده است، اما خطراتی را به همراه دارد. گاهی اوقات ویروس یک پاسخ ایمنی خطرناک را ایجاد می کند.
علاوه بر این، ناقل هایی که ماده ژنتیکی را در یک کروموزوم ادغام می کنند، می توانند خطاهایی ایجاد کنند که منجر به سرطان می شود. محققان در حال توسعه فناوری های جدیدتری هستند که می توانند مواد ژنتیکی یا ابزارهای ویرایش ژن را بدون استفاده از ویروس ها ارائه دهند. یکی از این تکنیکها از ساختارهای ویژهای به نام نانوذرات بهعنوان ناقل برای رساندن ماده ژنتیکی یا اجزای ویرایشکننده ژن به سلولها استفاده میکند.
نانوذرات ساختارهای فوقالعاده کوچکی هستند که برای مصارف مختلف ساخته شدهاند. برای ژن درمانی، این ذرات ریز با ویژگی های خاصی طراحی شده اند تا آنها را به انواع سلول های خاص هدف قرار دهند. نانوذرات نسبت به ناقلهای ویروسی احتمال کمتری در ایجاد واکنشهای ایمنی دارند و طراحی و اصلاح آنها برای اهداف خاص آسانتر است.
محققان برای غلبه بر بسیاری از چالش های فنی ژن درمانی به کار خود ادامه می دهند. برای مثال، دانشمندان در حال یافتن راههای بهتری برای تحویل ژنها یا ابزارهای ویرایش ژن و هدف قرار دادن آنها به سلولهای خاص هستند.
آیا ژن درمانی بی خطر است؟
اولین آزمایش ژن درمانی بیش از سی سال پیش انجام شد. اولین مطالعات نشان داد که ژن درمانی می تواند خطرات بسیار جدی برای سلامتی مانند سمیت، التهاب و سرطان داشته باشد. از آن زمان، محققان مکانیسمها را مطالعه کرده و تکنیکهای بهبود یافتهای را توسعه دادهاند که احتمال کمتری برای ایجاد واکنشهای ایمنی خطرناک یا سرطان دارند.
از آنجایی که تکنیک های ژن درمانی نسبتا جدید هستند، برخی از خطرات ممکن است غیرقابل پیش بینی باشند. با این حال، محققان پزشکی، موسسات و آژانس های نظارتی در تلاش هستند تا اطمینان حاصل کنند که تحقیقات ژن درمانی، آزمایشات بالینی و درمان های تایید شده تا حد امکان ایمن هستند.
قوانین، مقررات و دستورالعمل های فدرال جامع به محافظت از افرادی که در مطالعات تحقیقاتی شرکت می کنند (کارآزمایی های بالینی) کمک می کند. سازمان غذا و داروی ایالات متحده (FDA) کلیه محصولات ژن درمانی در ایالات متحده را تنظیم می کند و بر تحقیقات در این زمینه نظارت می کند.
محققانی که می خواهند یک رویکرد را در یک کارآزمایی بالینی آزمایش کنند، ابتدا باید از FDA مجوز بگیرند. FDA این اختیار را دارد که آزمایشات بالینی را که مشکوک به ناامن بودن برای شرکت کنندگان هستند، رد یا تعلیق کند.
مؤسسه ملی بهداشت (NIH) نیز نقش مهمی در تضمین ایمنی تحقیقات ژن درمانی ایفا می کند. NIH دستورالعمل هایی را برای محققین و مؤسسات مانند دانشگاه ها و بیمارستان ها ارائه می دهد تا هنگام انجام آزمایشات بالینی با ژن درمانی از آنها پیروی کنند.
این دستورالعمل ها بیان می کند که آزمایشات بالینی در مؤسساتی که بودجه NIH برای این نوع تحقیقات دریافت می کنند باید در دفتر فعالیت های بیوتکنولوژی NIH ثبت شوند. پروتکل یا طرح برای هر کارآزمایی بالینی، در مرحله بعد توسط کمیته مشورتی DNA نوترکیب NIH (RAC) بررسی میشود تا مشخص شود که این پروتکل مسائل پزشکی، اخلاقی یا ایمنی را مطرح میکند که مستلزم بحث بیشتر در جلسه عمومی RAC است.
یک هیئت بررسی نهادی (IRB) و یک کمیته ایمنی زیستی سازمانی (IBC) باید هر کارآزمایی بالینی ژن درمانی را قبل از انجام آن تأیید کنند. IRB کمیته ای متشکل از مشاوران و مصرف کنندگان علمی و پزشکی است که تمام تحقیقات درون یک موسسه را بررسی می کند. IBC گروهی است که مطالعات تحقیقاتی بالقوه خطرناک یک موسسه را بررسی و تایید می کند. سطوح متعدد ارزیابی و نظارت تضمین میکند که نگرانیهای ایمنی در برنامهریزی و انجام تحقیقات ژن درمانی در اولویت قرار دارند.
فرآیند کارآزمایی بالینی در سه مرحله انجام می شود. مطالعات مرحله اول مشخص می کند که آیا یک درمان برای افراد بی خطر است یا خیر و عوارض جانبی آن را شناسایی می کند. مطالعات مرحله دوم تعیین می کند که آیا درمان موثر است یا خیر.
مطالعات فاز III، درمان جدید را با درمان های موجود مقایسه می کند. پزشکان میخواهند بدانند که آیا درمان جدید بهتر از درمان استاندارد کار میکند یا عوارض جانبی کمتری دارد. FDA نتایج کارآزمایی بالینی را بررسی می کند. اگر تشخیص دهد که مزایای درمان جدید بیشتر از عوارض جانبی است، درمان را تأیید می کند و پزشکان می توانند از آن برای درمان یک اختلال استفاده کنند.
آزمایشهای بالینی موفقیتآمیز منجر به تأیید تعداد کمی از درمانهای ژنی، از جمله درمانهایی برای درمان اختلالات ارثی مانند آتروفی عضلانی نخاعی و Leber congenital amaurosis شده است.
مسائل اخلاقی پیرامون ژن درمانی چیست؟
از آنجایی که ژن درمانی شامل ایجاد تغییراتی در بلوک های ساختمانی اصلی بدن (DNA) است، نگرانی های اخلاقی منحصر به فردی را ایجاد می کند. سوالات اخلاقی پیرامون ژن درمانی و ویرایش ژنوم عبارتند از:
- چگونه می توان کاربردهای خوب و بد این فناوری ها را تشخیص داد؟
- چه کسی تصمیم می گیرد که کدام صفات طبیعی هستند و کدام یک ناتوانی یا اختلال هستند؟
- آیا هزینه های بالای ژن درمانی آن را تنها در اختیار افراد ثروتمند قرار می دهد؟
- آیا افراد باید اجازه داشته باشند که از ژن درمانی برای تقویت صفات اولیه انسانی مانند قد، هوش یا توانایی ورزشی استفاده کنند؟
تحقیقات فعلی در مورد ژن درمانی بر هدف قرار دادن سلول های بدن (سوماتیک) مانند مغز استخوان یا سلول های خون متمرکز شده است. این نوع تغییر ژنتیکی نمی تواند به فرزندان فرد منتقل شود. با این حال، ژن درمانی می تواند سلول های تخمک و اسپرم (سلول های زاینده) را هدف قرار دهد که اجازه می دهد تغییرات ژنتیکی به نسل های آینده منتقل شود. این رویکرد به عنوان ژن درمانی germline شناخته می شود.
ایده این تغییرات بحث برانگیز است. در حالی که می تواند نسل های آینده در یک خانواده را از داشتن یک اختلال ژنتیکی خاص در امان نگه دارد، ممکن است بر رشد جنین به روش های غیرمنتظره ای تأثیر بگذارد یا عوارض جانبی طولانی مدتی داشته باشد که هنوز مشخص نیست.
از آنجایی که افرادی که تحت تأثیر ژن درمانی germline قرار می گیرند هنوز متولد نشده اند، نمی توانند انتخاب کنند که آیا این درمان را انجام دهند یا خیر. به دلیل این نگرانیهای اخلاقی، دولت ایالات متحده اجازه نمیدهد از بودجه فدرال برای تحقیق در مورد ژن درمانی در افراد استفاده شود.
آیا ژن درمانی برای درمان اختلال در دسترس است؟

ژن درمانی در حال حاضر عمدتا در یک محیط تحقیقاتی در دسترس است. سازمان غذا و داروی ایالات متحده (FDA) تنها تعداد کمی از محصولات ژن درمانی را برای فروش در ایالات متحده تایید کرده است.
به عنوان مثال، ژن درمانی تایید شده توسط FDA برای شرایطی در دسترس است که شامل یک اختلال چشمی نادر به نام Leber congenital amaurosis، نوعی سرطان پوست به نام ملانوم، و یک بیماری عضلانی ژنتیکی به نام آتروفی عضلانی نخاعی است. سایر درمان های ژنتیکی برای سرطان های سلول های خونی مانند لنفوم و مولتیپل میلوما تایید شده اند. ژن درمانی برای درمان شرایط اضافی در کشورهای دیگر تایید شده است.
صدها مطالعه تحقیقاتی (کارآزمایی بالینی) برای آزمایش ژن درمانی به عنوان درمانی برای شرایط ژنتیکی، سرطان و HIV/AIDS در حال انجام است. اگر علاقه مند به شرکت در یک کارآزمایی بالینی هستید، با پزشک یا متخصص ژنتیک در مورد نحوه شرکت می توانید صحبت کنید.
CAR T Cell therapy، RNA therapy و سایر درمان های ژنتیکی چیست؟
چندین درمان ایجاد شده است که شامل مواد ژنتیکی است اما به طور معمول ژن درمانی در نظر گرفته نمی شود. برخی از این روش ها DNA را برای استفاده کمی متفاوت از ژن درمانی تغییر می دهند. برخی دیگر ژنها را تغییر نمیدهند، اما دستورالعملهای یک ژن برای ساخت پروتئین را تغییر می دهند.
ژن درمانی مبتنی بر سلول
سلول درمانی CAR T (یا درمان با گیرنده آنتی ژن کایمریک سلول T) نمونه ای از ژن درمانی مبتنی بر سلول است. این نوع درمان ترکیبی از فن آوری های ژن درمانی و سلول درمانی است. سلول درمانی سلول هایی را به بدن معرفی می کند که عملکرد خاصی برای کمک به درمان بیماری دارند. در ژن درمانی مبتنی بر سلول، سلول ها از نظر ژنتیکی تغییر داده شده اند تا عملکرد ویژه ای به آنها بدهند.
سلول درمانی CAR T یک ژن را به سلول های T فرد که نوعی سلول ایمنی هستند، معرفی می کند. این ژن دستورالعمل هایی را برای ساخت پروتئینی به نام گیرنده آنتی ژن کایمریک (CAR) ارائه می دهد که به سلول های سرطانی متصل می شود. سلول های ایمنی اصلاح شده می توانند به طور خاص به سلول های سرطانی حمله کنند.
RNA درمانی
چندین تکنیک، به نام درمان RNA، از قطعات RNA، که نوعی ماده ژنتیکی مشابه DNA است، برای کمک به درمان یک اختلال استفاده میکنند. در بسیاری از این تکنیک ها، قطعات RNA با مولکولی به نام RNA پیام رسان (یا به اختصار mRNA) برهم کنش می کنند. در سلول ها، mRNA از اطلاعات موجود در ژن ها برای ایجاد طرحی برای ساخت پروتئین ها استفاده می کند.
با تعامل با mRNA، این درمانها بر میزان پروتئین تولید شده از یک ژن تأثیر میگذارند که میتواند اثرات یک تغییر ژنتیکی را جبران کند. نمونههایی از این درمانهای RNA شامل درمانهای الیگونوکلئوتید آنتیسنس (ASO)، RNA مداخلهگر کوچک (siRNA) و میکرو RNA (miRNA) است. یک RNA درمانی به نام RNA آپتامر درمانی، قطعات کوچکی از RNA را معرفی می کند که مستقیما به پروتئین ها متصل می شوند تا عملکرد آنها را تغییر دهند.
درمان اپی ژنتیک
یکی دیگر از درمان های مرتبط با ژن، به نام درمان اپی ژنتیک، بر تغییرات اپی ژنتیکی در سلول ها تأثیر می گذارد. تغییرات اپی ژنتیکی تغییرات خاصی هستند که به DNA متصل می شوند و روشن یا خاموش شدن ژن ها را کنترل می کنند. الگوهای غیر طبیعی تغییرات اپی ژنتیکی فعالیت ژن و متعاقبا تولید پروتئین را تغییر می دهد. درمان های اپی ژنتیک برای اصلاح خطاهای اپی ژنتیکی که زمینه ساز اختلالات ژنتیکی هستند استفاده می شود.
منبع:
Kim YK. RNA Therapy: Current Status and Future Potential. Chonnam Med J. 2020 May;56(2):87-93. doi: 10.4068/cmj.2020.56.2.87. Epub 2020 May 25. PubMed: 32509554. Free full-text article from PubMed Central: PMC7250668.
Lu Y, Chan YT, Tan HY, Li S, Wang N, Feng Y. Epigenetic regulation in human cancer: the potential role of epi-drug in cancer therapy. Mol Cancer. 2020 Apr 27;19(1):79. doi: 10.1186/s12943-020-01197-3. 32340605. Free full-text article from PubMed Central: PMC7184703.
Bulcha JT, Wang Y, Ma H, Tai PWL, Gao G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 2021 Feb 8;6(1):53. doi: 10.1038/s41392-021-00487-6. PMID: 33558455. Free full-text article from PubMed Central: PMC7868676.
Duan L, Ouyang K, Xu X, Xu L, Wen C, Zhou X, Qin Z, Xu Z, Sun W, Liang Y. Nanoparticle Delivery of CRISPR/Cas9 for Genome Editing. Front Genet. 2021 May 12;12:673286. doi: 10.3389/fgene.2021.673286. PubMed: 34054927. Free full-text article from PubMed Central: PMC8149999.
ژن درمانی: پیشرفت ها، چالش ها و دیدگاه ها

توانایی ایجاد تغییرات اختصاصی در ژنوم انسان از زمان به رسمیت شناختن ژن به عنوان واحد اساسی وراثت در پزشکی یک هدف بوده است. بنابراین، ژن درمانی به عنوان توانایی بهبود ژنتیکی از طریق اصلاح ژنهای تغییر یافته (جهش یافته) یا تغییرات مختص مکان با اهداف درمانی را مورد هدف قرار می دهد.
این درمان از طریق پیشرفتهای ژنتیک و مهندسی زیستی امکانپذیر شد که وکتورها را برای تحویل مواد خارج کروموزومی به سلولهای هدف دستکاری کرد. یکی از محورهای اصلی این تکنیک، بهینه سازی وسایل انتقال (وکتورها) است که عمدتا پلاسمید، نانوساختار یا ویروس هستند. این ویروس ها بیشتر به دلیل برتری آنها در حمله به سلول ها و وارد کردن مواد ژنتیکی آنها مورد بررسی قرار می گیرند.
با این حال، نگرانی زیادی در مورد تشدید پاسخ های ایمنی و دستکاری ژنوم، به ویژه در سلول های زایا وجود دارد. مطالعات in vivo در سلول های سوماتیک نتایج رضایت بخشی را با پروتکل های تایید شده در آزمایشات بالینی نشان داد. این آزمایشات در ایالات متحده، اروپا، استرالیا و چین انجام شده است.
پیشرفتهای بیوتکنولوژیکی اخیر، مانند سلولهای بنیادی پرتوان القایی در بیماران مبتلا به بیماریهای کبدی، ایمونوتراپی سلول T گیرنده آنتی ژن کایمریک و ویرایش ژنومی توسط CRISPR/Cas9 مورد بررسی قرار گرفتهاند.
در سال 1991، جیمز واتسون اعلام کرد که بسیاری از مردم می گویند که نگران تغییرات در دستورالعمل های ژنتیکی ما هستند. اما این دستورالعملهای ژنتیکی صرفا محصول تکامل هستند و به گونهای شکل گرفتهاند که بتوانیم با شرایط خاصی که ممکن است دیگر وجود نداشته باشند، سازگار شویم.
مطالعات ژنتیکی در اوایل دهه 1850 آغاز شد، زمانی که راهب اتریشی، گرگور مندل، در مجموعه ای از آزمایشات با نخود سبز، الگوی وراثت را با مشاهده آثاری که به عنوان واحدهای جداگانه به ارث رسیده بودند، توصیف کرد که امروزه ما آنها را به عنوان ژن می شناسیم.
تا سال 1950، اطلاعات کمی در مورد ماهیت فیزیکی ژن ها وجود داشت، یعنی زمانی که بیوشیمیدان آمریکایی، جیمز واتسون و بیوفیزیکدان انگلیسی، فرانسیس کریک، مدل انقلابی DNA دو رشته ای را توسعه دادند. در سال 1970، محققان مجموعهای از آنزیمها را کشف کردند که امکان جداسازی ژنها را در مکانهای از پیش تعیینشده در امتداد مولکول DNA و قرار دادن مجدد آنها به شیوهای تکرارپذیر فراهم میکرد.
این پیشرفت های ژنتیکی سناریوی ظهور مهندسی ژنتیک را با تولید داروها و آنتی بادی های جدید آماده کرد و از سال 1980، ژن درمانی توسط دانشمندان گنجانده شد. در این بررسی، ژن درمانی، روشهای مختلف مهندسی ژنتیک مورد استفاده برای این تکنیک، محدودیتها، کاربردها و دیدگاههای آن را پوشش میدهیم.
ژن درمانی
همانطور که گفته شد، توانایی ایجاد تغییرات موضعی در ژنوم انسان از زمان شناخت DNA به عنوان واحد اساسی وراثت، هدف پزشکی بوده است. ژن درمانی به عنوان ظرفیت بهبود ژن با استفاده از اصلاح ژن های تغییر یافته (جهش یافته) یا تغییرات مختص مکان درک می شود. در ادامه، استراتژیهای مختلفی شرح داده شده است که اغلب برای این منظور استفاده میشوند.
در حال حاضر، ژن درمانی منطقه ای است که عمدتا در آزمایشگاه های تحقیقاتی وجود دارد و کاربرد آن هنوز تجربی است. این رویکرد گسترده است که قادر به درمان بالقوه بیماری های ناشی از اختلالات ژنی مغلوب (فیبروز کیستیک، هموفیلی، دیستروفی عضلانی، و کم خونی داسی شکل)، بیماری های ژنتیکی اکتسابی مانند سرطان، و برخی عفونت های ویروسی مانند ایدز می باشد.
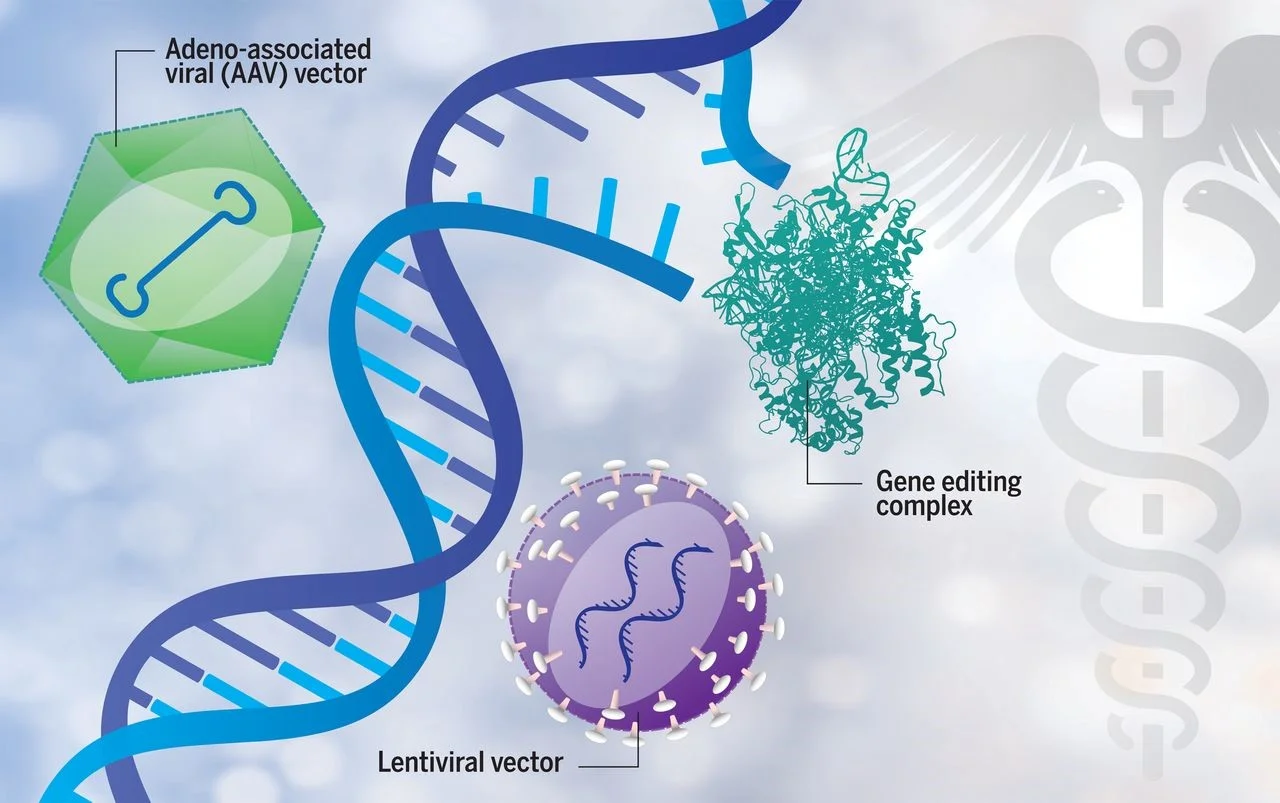
یکی از تکنیکهایی که اغلب مورد استفاده قرار میگیرد شامل فناوری DNA نوترکیب است که در آن ژن مورد نظر یا ژن سالم در یک ناقل قرار داده میشود که میتواند یک پلاسمید، نانوساختار یا ویروس باشد. این دومی به دلیل کارایی آن در حمله به سلول ها و معرفی مواد ژنتیکی، بیشترین کاربرد را دارد.
اگرچه چندین پروتکل موفقیت آمیز برای ژن درمانی وجود دارد ولی روند ژن درمانی همچنان پیچیده است و بسیاری از تکنیک ها به پیشرفت های جدید نیاز دارند. سلول های خاص بدن که نیاز به درمان دارند باید شناسایی و در دسترس باشند.
راهی برای توزیع مؤثر نسخههای ژنی در سلولها باید در دسترس باشد و بیماریها و پیوندهای ژنتیکی دقیق آنها باید کاملا درک شود.
همچنین موضوع مهم دیگر، نوع سلولهای هدف در ژندرمانی است که به دو گروه بزرگ تقسیم می شوند: ژن درمانی germline و ژن درمانی سلول های سوماتیک. در ژن درمانی germline، سلول های بنیادی با اسپرم و تخمک، با معرفی ژن های عملکردی اصلاح می شوند و در ژنوم ادغام می شوند. تغییرات ارثی هستند و به نسل های بعدی منتقل می شوند.
در تئوری، این رویکرد باید در مبارزه با بیماری های ژنتیکی و ارثی بسیار موثر باشد. ژن درمانی سلول سوماتیک زمانی است که ژن های درمانی به سلول های بدنی بیمار منتقل می شود. هر گونه تغییر و هر گونه تاثیری فقط به آن بیمار محدود می شود و به نسل های آینده به ارث نمی رسد.
فرآیند ژن درمانی: آزادسازی ژن
در ژن درمانی، یک ژن طبیعی به ژنوم وارد می شود تا جایگزین یک ژن غیر طبیعی مسئول ایجاد یک بیماری خاص شود. از میان چالشهای مختلف درگیر در این فرآیند، یکی از مهمترین چالشها، مشکل در آزادسازی ژن در سلول بنیادی است.
بنابراین، یک حامل مولکولی به نام وکتور برای آزاد کردن ژن استفاده می شود، که باید بسیار خاص باشد، کارایی را در آزادسازی یک یا چند ژن در اندازه های لازم برای کاربردهای بالینی نشان دهد، که توسط سیستم ایمنی تشخیص داده نشود و در مقادیر زیاد و غلظت بالا خالص شود تا بتوان آن را در مقیاس وسیع تولید و در دسترس قرار داد.
هنگامی که وکتور وارد بیمار می شود، نمی تواند واکنش های آلرژیک یا فرآیند التهابی را القا کند. باید عملکردهای طبیعی را افزایش دهد، کمبودها را اصلاح کند یا از فعالیت های مضر جلوگیری کند. علاوه بر این، نه تنها برای بیمار، بلکه برای محیط زیست و متخصصانی که آن را دستکاری می کنند نیز باید ایمن باشد. در نهایت، وکتور باید قادر به بیان ژن، به طور کلی، برای کل زندگی بیمار باشد.
اگرچه کارایی ناقل های ویروسی تایید شده است، اخیرا برخی از مطالعات نشان داده اند که استفاده از این حامل ها با محدودیت های متعددی همراه است. وجود ماده ژنتیکی ویروسی در پلاسمید یک عامل تشدید کننده قوی است، زیرا می تواند یک پاسخ ایمنی حاد را القا کند. در حال حاضر، دو رویکرد اصلی برای تغییرات ژنتیکی سلولها وجود دارد که یکی با واسطه ویروس و یکی از طریق مکانیسمهای فیزیکی می باشد.
در این زمینه، پلیمرهایی وجود دارند که شبکههایی را تشکیل میدهند که یک ژن را جذب کرده و هنگامی که آنها به سلول ها نفوذ می کنند، بار آن را آزاد می کنند، مانند DNA microinjection، پلیمرهای کاتیونی، لیپوزوم های کاتیونی و … .
هر تکنیک معرفی مواد اگزوژن با دیگری متفاوت است و به نوع کاربرد پیشنهادی بستگی دارد. برخی کارآمدتر هستند، برخی دیگر برای حمل ژن های بزرگ (> 10 کیلوبایت) و ادغام با ژنوم، امکان بیان دائمی را دارند.
ژن درمانی و سلول های بنیادی خون ساز
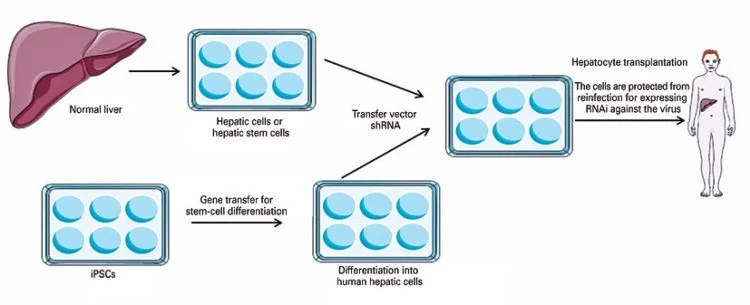
سلول های بنیادی خونساز به دلیل پتانسیل بالا برای طول عمر و ظرفیت خود بازسازی به اهداف ایده آلی برای انتقال ژن تبدیل شده اند. یکی از نمونههای این ترکیب ژن درمانی و سلولهای بنیادی، تولید ناقلهای انتقال ژن برای ایجاد سلولهای بنیادی پرتوان القایی (iPS)، به منظور ایجاد تمایز iPS و ارائه یک فنوتیپ اضافی از این سلول مشتق شده تمایز یافته است.
بیماران مبتلا به بیماری مزمن کبدی و عفونت با ویروس هپاتیت (به عنوان مثال ویروس هپاتیت B و ویروس هپاتیت C) که نیاز به پیوند کبد دارند، ممکن است تحت تاثیر پیوند کبدی سلولهای کبدی بالغ یا آنهایی که از iPS مشتق شدهاند، قرار گیرد. تنها انتقال ژن ها ممکن است برای تبدیل سلول های بنیادی به سلول های کبدی مورد نیاز باشد.
از آنجایی که سلولهای پیوندی مستعد عفونت مجدد توسط ویروس هپاتیت هستند، انتقال ناقلی که یک RNA سنجاق سری کوتاه را که علیه ویروس است کد میکند، سلولهای انتقالیافته را با مقاومت یا ایمنی در برابر عفونت مجدد ایجاد میکند. سلول های مقاوم می توانند به مرور زمان کبد را مجددا جمع کنند و عملکرد طبیعی کبد را بازیابی کنند.
درمان با سلول های T گیرنده آنتی ژن کایمریک
درمان از طریق سلول T گیرنده آنتی ژن کایمریک (CAR-T)، نوعی ایمونوتراپی است که شامل دستکاری یا برنامه ریزی مجدد سلول های ایمنی (لنفوسیت های T) خود بیماران به منظور شناسایی و حمله به سلول های T تومور است.
پیشرفت اولیه در طراحی اولین نسل CAR توسط اشهر و همکاران با ادغام یک متغیر تک زنجیره ای (scFv) به یک حوزه گذرنده و یک واحد سیگنال دهی درون سلولی مشخص شد: زنجیره CD3 zeta. این طرح، عنصر فعال یک آنتی بادی مونوکلونال به خوبی مشخص شده را با یک دامنه سیگنالینگ ترکیب می کند و تشخیص اپی توپ خاص تومور و فعال شدن سلول های T را بدون وابستگی به مولکول های مجموعه سازگاری بافتی افزایش می دهد.
بهبود در نسل اول CAR با استفاده از ادغام مولکولهای همتحریک لازم برای انتقال سیگنال انجام شد. گیرنده تحریکی که بیشتر در این نسل CAR استفاده می شود CD28 است. این گیرنده به عنوان دومین رویداد فعال کننده مسیر عمل می کند و تکثیر مشخص سلول های T همراه با افزایش بیان سیتوکین ها را ممکن می سازد.
جدیدترین نسل CAR از افزودن یک دامنه تحریکی برای افزایش عملکرد CAR استفاده کرد. مولکولهای تحریککننده مشترک به عنوان دریافتکننده فاکتور نکروز تومور (CD134 یا CD137) برای این روش مورد نیاز هستند. به طور خلاصه، جدیدترین اشکال CAR شامل scFv، زنجیره اولیه CD3-ζ، همراه با زنجیره های تحریکی CD28 و CD134 یا CD137 است.
با نسل سوم CAR، ژونگ و همکاران بهبودی در فعال سازی سلول T پروتئین کیناز B به نام Akt را نشان دادند که چرخه سلولی را تنظیم می کند. طبق مطالعات دیگر، این نسل آخر ماندگاری سلول های T را در مقایسه با نسل دوم CAR نشان می دهد.
بحرانی ترین نقطه از عوارض جانبی درمان CAR-T، شناسایی سلول های غیر توموری است که اپی توپ هدف را توسط CAR بیان می کنند. آنتی ژن های تومور مولکول هایی هستند که در سلول های تومور به شدت بیان می شوند، اما منحصر به این سلول ها نیستند. به عنوان مثال، آنتی ژن CD19 را می توان در سلول های B طبیعی یا بدخیم یافت و طراحی CAR برای هدف CD19 قادر به تشخیص آنها نیست.
پیشرفتهای جدید در طراحی وکتورها و آزمایشها با CAR-T تعادل و تقویت ایمنی را برای تقویت کاربرد بالینی فراهم میکند. همانطور که از نسل اول تا سوم مشاهده شد، پیشرفت تدریجی در آزمایشات CAR قبلا پیشرفت کرده است. دانش و تجربه به دست آمده در ارزیابی سمیت CAR-T موفقیت پیشرفت های پیشرونده را برای آزمایشات آینده افزایش می دهد.
CRISPR-Cas9
در طول دهه 1980، در ژنوم اشریشیا کلی، منطقه ای با یک الگوی غیرمعمول شناسایی شد که در آن یک توالی بسیار متغیر توسط یک توالی مکرر و بدون عملکرد شناخته شده در هم آمیخت. در سال 2005، فرض بر این بود که توالیهای متغیر منشأ خارج کروموزومی دارند و به عنوان یک حافظه ایمنی در برابر فاژها و پلاسمیدها عمل میکنن که این پدیده آغازگر سیستم CRISPR-Cas9 می باشد که از سال 2012 به عنوان یکی از ابزارهای اولیه بیوتکنولوژی برای ویرایش ژن بکار گرفته شد.
این مکانیسم که در سیستم ایمنی تطبیق پذیر پروکاریوتی ها سرچشمه می گیرد، ماده ژنتیکی مهاجم را شناسایی می کند، آن را به قطعات کوچک می شکافد و آن را در DNA خود ادغام می کند. در عفونت دوم توسط همان عامل، توالی زیر رخ می دهد: رونویسی مکان CRISPR، پردازش mRNA و ایجاد قطعات کوچک RNA به نام crRNAs که با پروتئین های Cas کمپلکس تشکیل می دهند و اینها اسیدهای نوکلئیک بیگانه را تشخیص می دهند و در نهایت نابودشان می کنند.
بر اساس این مکانیسم طبیعی، تکنیک CRIPSR توسعه یافت که امکان ویرایش توالیهای DNA خاص هدف ژنوم هر موجود زنده را با استفاده از سه مولکول نوکلئاز (Cas9) که مسئول برش DNA دو رشته ای می باشد. یک RNA راهنما که مجموعه را به سمت هدف هدایت می کند و DNA هدف اینکار انجام می شود.
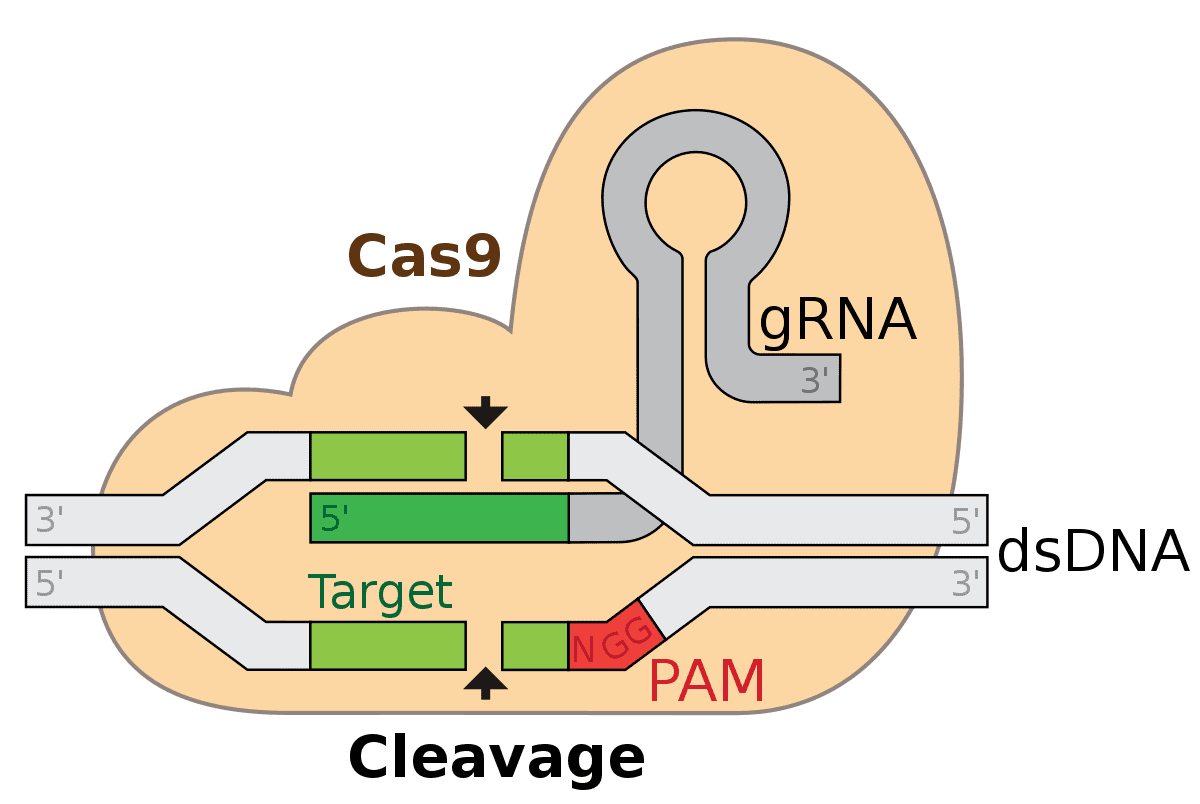
به دلیل سادگی و دقت آن در مقایسه با سایر تکنیک ها (نوکلئازهای انگشت روی، TALEN و هدف گیری ژن)، سیستم CRISPR به عنوان یک ابزار همه کاره است که ویرایش ژنتیکی را با استفاده از غیر فعال کردن، یکپارچه سازی توالی های اگزوژن و جایگزینی آللی انجام می دهد.
RNA راهنما با DNA هدف هیبرید می شود. Cas9 این کمپلکس را تشخیص می دهد و باید در جداسازی دو رشته DNA و ترمیم در حضور یک DNA دهنده (همولوگ) واسطه شود. نتیجه این فرآیند ادغام یک توالی اگزوژن در ژنوم (knock-in) یا جایگزینی آلل است.
محققان دانشگاه کالیفرنیا و یوتا اخیرا در تصحیح جهش ژن هموگلوبین که منشا کم خونی سلول داسی است، موفق شدند. سلول های CD34+ از بیمارانی که ناقل کم خونی داسی شکل هستند، توسط CRISPR-Cas9 ویرایش شد و پس از 16 هفته، نتایج نشان دهنده کاهش سطح بیان ژن جهش یافته و افزایش بیان ژن از نوع وحشی بود.
فناوری اشاره شده عمدتا در آسیب شناسی های ژنتیکی تک ژنی مورد استفاده قرار می گیرد، که با وجود نادر بودن، می تواند به حدود 10 هزار بیماری که قبلا شرح داده شده است برسد.
مسائل اخلاقی
امکان تغییر ژنتیکی germline برای مدت طولانی موضوع بحث داغ در زمینه علم بوده است. اخلاق زیستی همیشه هنگام ایجاد تکنیک های جدید وجود دارد تا خطرات این روش و پیامدهای اخلاقی مربوطه را ارزیابی کند. بخش بزرگی از جامعه علمی، ژنتیک درمانی را در سلولهای سوماتیک به ویژه در موارد اختلالات شدید مانند فیبروز کیستیک و دیستروفی عضلانی دوشن تأیید میکنند.
اما در سال 2015، محققان چینی از مسائل اخلاقی فراتر رفتند و برای اولین بار اصلاح ژنتیکی سلول های جنینی را با استفاده از تکنیک CRISPR-Cas9 اعلام کردند. سپس، یک گروه چینی دیگر نیز انجام همان فرآیند را با هدف ایجاد مقاومت در برابر HIV با درج جهش ژن CCR5 گزارش کردند. تجزیه و تحلیل ژنتیکی نشان داد که 4 جنین از 26 جنین با موفقیت اصلاح شدند. نتیجه به وضوح نیاز به بهبود تکنیک را نشان می دهد و هشدار می دهد که احتمالا چنین آزمایشاتی می تواند قبلا در مدل های حیوانی آزمایش شود.
این انتشارات اخیر دوباره بحث در مورد ویرایش ژنتیکی را برانگیخت. از یک طرف، کمیته اخلاق ژاپن اعلام کرد که روش انجام آزمایش صحیح است، زیرا تأییدیه کمیته اخلاق محلی برای مطالعه انجام شده و همچنین رضایت اهداکنندگان تخمک وجود دارد. در انگلستان، اولین پروژه برای ویرایش جنین انسان سالم مورد تایید قرار گرفت. از سوی دیگر، گروههای تحقیقاتی آمریکایی محافظهکار باقی ماندند و موضع خود را مبنی بر عدم حمایت از این نوع آزمایشها تکرار کردند و اعلام کردند که منتظر بهبود تکنیکها و تعاریف مسائل اخلاقی هستند.
از زمان اعلام جیمز واتسون در سال 1991، با اشاره به بهینه سازی احتمالی ژنتیک انسانی، ژن درمانی در طول دهه ها پیشرفت کرده است، چه با بهینه سازی انواع ناقل ها، چه با معرفی تکنیک های جدید، مانند سلول های بنیادی پرتوان القایی در ترکیب با مدلهای فعلی ویرایش ژنتیکی مانند CRISPR-Cas9 و حتی با آزمایش هایی در سلول های germline و جنبه های اخلاقی شاهد پیشرفت در این زمینه بوده ایم.
موفقیتها در زمینه ژن درمانی در حال حاضر قابلیت دوام درمانهای با استفاده از ژن درمانی را در عمل بالینی، به عنوان یک شکل جایگزین برای بیماران مبتلا به بیماریهای مادرزادی یا اختلالات تک ژنی و سرطان، بهویژه زمانی که مداخلات دارویی یا جراحی نتایج خوبی نشان نمیدهند، تقویت کرده است.
طراحی وکتورهای آزمایشی جدید، افزایش کارایی، ویژگی سیستم های تحویل و درک بیشتر از القای پاسخ التهابی ممکن است بهبود ایمنی را با گسترش تکنیک ها در کاربردهای بالینی متعادل کند. با این حال، دانش و تجربه بهدستآمده با ارزیابی دقیق سمیت این فناوریها، پیشرفتهای قابل توجهی را در کاربرد این روشها ممکن میسازد.
بنابراین، از نظر تاریخی، ژن درمانی و کشف آنتی بیوتیک ها و عوامل شیمی درمانی یا هر فناوری جدید نیاز به مطالعات پیش بالینی روشن تر دارد. در آینده، نوید استفاده از این تکنیک ها در چندین زمینه پزشکی و درصد بیشتری از کارآزمایی های بالینی وجود دارد.
- Mukherjee S. Mukherjee S. The gene: an intimate history. Nova York: Scribner; 2016. Genetic therapies: posthuman gene therapy.415 Chap. 34. [Google Scholar]
- Friedmann T. A brief history of gene therapy. Nat Genet. 1992;2(2):93–98. Review. [PubMed] [Google Scholar]
- Misra S. Human gene therapy: a brief overview of the genetic revolution. J Assoc Physicians India. 2013;61(2):127–133. Review. [PubMed] [Google Scholar]
- Tebas P, Stein D, Tang WW, Frank I, Wang SQ, Lee G, et al. Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV. N Engl J Med. 2014;370(10):901–910. [PMC free article] [PubMed] [Google Scholar]
- Linden R. Gene therapy: what it is, what it is not and what it will be. Estud Av. 2010;24(70):31–69. [Google Scholar]
- Ginter EK. Gene therapy of hereditary diseases. Vopr Med Khim. 2000;46(3):265–278. Review. Russian. [PubMed] [Google Scholar]
- Mathews QL, Curiel DT. Gene therapy: human germline genetics modifications-assessing the scientific, socioethical, and religious issues. South Med J. 2007;100(1):98–100. [PubMed] [Google Scholar]
- Bank A. Human somatic cell gene therapy. Bioessays. 1996;18(12):999–1007. Review. [PubMed] [Google Scholar]
- Nabel GJ, Chang AE, Nabel EG, Plautz GE, Ensminger W, Fox BA, et al. Immunotherapy for cancer by direct gene transfer into tumors. Hum Gene Ther. 1994;5(1):57–77. [PubMed] [Google Scholar]
- Yang Y, Nunes FA, Berencsi K, Furth EE, Gönczöl E, Wilson JM. Cellular immunity to viral antigens limits E1-deleted adenoviruses for gene therapy. Proc Natl Acad Sci U S A. 1994;91(10):4407–4411. [PMC free article] [PubMed] [Google Scholar]
- Kay MA. State-of-the-art gene-based therapies: the road ahead. Nat Rev Genet. 2011;12(5):316–328. Review. [PubMed] [Google Scholar]
- Eshhar Z, Waks T, Gross G, Schindler DG. Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors. Proc Natl Acad Sci U S A. 1993;90(2):720–724. [PMC free article] [PubMed] [Google Scholar]
- Gross G, Waks T, Eshhar Z. Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proc Natl Acad Sci U S A. 1989;86(24):10024–10028. [PMC free article] [PubMed] [Google Scholar]
- Parham P. Parham P. The immune system. 3rd. Nova York: Garland Science; 2009. Antigen recognition by T lymphocytes.113 Chap. 5. [Google Scholar]
The course entitled “Gene therapy” at Geniran laboratory covers following topics
Examining the origin of genomic information and genomic data
Recombinant proteins and their application in gene therapy
The principles of cloning and its applications from design to implementation
for therapeutic purposes
Understanding the principles of gene editing and examining new findings in this field and how it works in the treatment of diseases
CRISPR-Cas9 technology in genome editing
Preparing the desired vector and inserted piece
pET expression system, types of vectors and their selection
How to design, clone and deliver sgRNA
In silico analyses








سلام وقت به خیر من میخواستم دوره انلاین ژن درمانی رو ثبت نام کنم چون ظرفیتش کمه میخوام پیش ثبت نام انجام بدم
جهت ثبت نام با ما تماس بگیرید یا از تصویر ثبت نام در همین صفحه استفاده کنید